№9-1|2011
ИННОВАЦИИ ВОДНОГО СЕКТОРА
bbk 000000
УДК 628.31:577.472
Флуоресцентные методы мониторинга процесса получения биомассы из микроводорослей
Аннотация
Развитие технологий очистки бытовых сточных вод с применением фотоавтотрофов до нынешнего момента сдерживалось отсутствием способов переработки получаемой биомассы. В последние годы наблюдается активное развитие таких технологий. Преимущества микроводорослей перед другими источниками биомассы огромны: наивысшая продуктивность и способность очищать воду от биогенных элементов до качества самых чистых водоемов. Специалистами МГУП «Мосводоканал» и Московского государственного университета имени М.В.Ломоносова изучен процесс получения биомассы микроводорослей на сточной воде с использованием современных флуоресцентных методов. В лабораторном фотобиореакторе выявлена зависимость содержания хлорофилла «а» и биомассы водорослей от показателя флуоресценции F0 и прироста биомассы от параметра Fv/Fm.
Ключевые слова
мониторинг , биогенные элементы , микроводоросли , хлорофилл , флуоресценция , фотобиореактор
Скачать статью в журнальной верстке (PDF)
Введение
В больших городах проблема загрязнения природных вод биогенными элементами приобретает повышенную остроту. С этой проблемой связано развитие избыточного количества фитопланктона в водоемах, который не поглощается зоопланктоном и рыбами и создает предпосылки для загрязнения воды органическими соединениями. Значительная часть биогенных элементов поступает в водоемы с хозяйственно-бытовыми стоками.
Удаление биогенных элементов из сточных вод осуществляется на очистных сооружениях биологическими методами. Очистка от азота проводится процессами нитрификации (удаление аммонийного азота) и денитрификации (удаление нитритного и нитратного азота), а очистка от фосфора – удалением с помощью бактерий, аккумулирующих фосфор в биомассе. Недостатком этих способов является то, что бактериям для удаления азота и фосфора необходимо биологически доступное органическое вещество, которого не всегда достаточно в городских сточных водах.
Одним из методов, позволяющих удалять азот и фосфор в отсутствие органического вещества, является применение для очистки фотоавтотрофов, которые при создании биомассы используют солнечный свет в отличие бактерий, для которых нужна энергия органического вещества. Наиболее продуктивными из всех фотоавтотрофов являются микроводоросли.
Развитие технологий очистки хозяйственно-бытовых сточных вод с применением фотоавтотрофов до нынешнего момента сдерживалось отсутствием способов переработки получаемой биомассы. В последние годы наблюдается активное развитие таких технологий [1; 2]. Преимущества микроводорослей перед другими источниками биомассы огромны: наивысшая продуктивность и способность очищать воду от биогенных элементов до качества самых чистых водоемов.
Уникальными условиями для выращивания водорослей обладают сооружения очистки сточных вод. Здесь необходимые условия для фотосинтеза существуют в течение всего года: теплая вода, биогенные элементы (остающиеся в воде после очистки ее активным илом), углекислый газ (образующийся в результате окисления органического вещества и сжигания метана на ТЭС). При производстве 1 кг сухой биомассы водорослей потребляется: 1,9 кг углекислого газа, 80 г азота и 13 г фосфора. Получаемая биомасса – сырье для ряда ценных продуктов: биотоплива, органического удобрения или корма для животных. Очистные сооружения в результате использования данной технологии получают статьи дохода от продажи (или использования для внутренних нужд) энергии из биомассы, а также от продажи квот на утилизацию углекислого газа.
В мире разработаны и промышленно используются фотобиореакторы для выращивания биомассы микроводорослей на очищенных стоках [3–5].
В разных регионах доступность в количестве солнечной энергии различна. Очевидно, что наибольшее количество энергии поступает в низких широтах. Так, для Москвы (55,7 с. ш.) интенсивность радиации почти в 2 раза ниже, чем для экваториальных стран. Однако европейский опыт показывает, что страны средних широт с успехом могут применять солнечную энергию для энергетических нужд. Так, лидером по ее использованию является Германия. Развивающееся быстрыми темпами производство оборудования для концентрирования солнечной энергии позволяет внедрять данную технологию даже в средних широтах.
В 2008–2010 годах специалистами МГУП «Мосводоканал» проведены работы по получению биомассы водорослей на биологически очищенной воде и переработке ее в биотопливо. Основные технологические этапы:
- – выведен устойчивый биоценоз водорослей, дающий оптимальный прирост на очищенной воде Курьяновских очистных сооружений;
- – разработаны технические решения по созданию фотобиореактора, определены режимы его функционирования (возраст культуры, тип реактора);
- – найдены технические решения по обеспечению фотобиореактора солнечным светом для оптимального использования солнечной энергии;
- – проработан вопрос утилизации углекислого газа, образуемого на ТЭЦ, для повышения продуктивности;
- – проработан вопрос выделения биомассы водорослей из раствора;
- – ведется работа по оценке биогазового потенциала выращенных водорослей и поиску путей рентабельной реализации получаемой биомассы.
В Инженерно-технологическом центре МГУП «Мосводоканал» на Курьяновских очистных сооружениях создана и запущена в действие пилотная установка, представляющая собой фотобиореактор с микроводорослями [2].
Для дальнейшего усовершенствования технологического процесса важной задачей является непрерывное наблюдение за состоянием фотосинтетического аппарата популяции микроводорослей, так как от этого зависит продукция биомассы. Прогнозирование ухудшения состояния водорослей позволяет своевременно регулировать технологический процесс, поддерживая максимальную продуктивность. В лабораторных условиях состояние обычно оценивается по стабильности видового состава и уровню хлорофилла «а» [6]. При реализации промышленных проектов данный вид технологического мониторинга чрезвычайно трудоемок и занимает много времени.
Известно, что при действии различных экологических и технологических факторов на микроводоросли в первую очередь изменяется их фотосинтетическая активность, которая и определяет численность клеток водорослей [7]. Это справедливо как для природных водоемов, так и для промышленных фотобиореакторов. Для быстрой диагностики состояния фитоценоза в природных условиях развиваются современные методы регистрации флуоресценции хлорофилла, которые позволяют получать информацию о количестве и активности фототрофных организмов in situ [8–12].
Сокращение трудозатрат при проведении технологического мониторинга является насущной задачей современного производственного процесса. Поэтому основной целью настоящей работы являлось изучение изменений состояния микроводорослей в условиях культивирования с использованием современных флуоресцентных методов.
Материалы и методы исследования
Лабораторный фотобиореактор (рис. 1) состоит из колонн с культурой водорослей; системы освещения (3000 люкс); системы подачи и распределения воздуха (для снабжения водорослей СО2 и для перемешивания биомассы в колоннах); системы подачи очищенной сточной воды один раз в сутки взамен слитой воды из реактора; системы обезвоживания биомассы фильтрованием с применением вакуумного насоса (фильтр с размером пор 3 мкм).
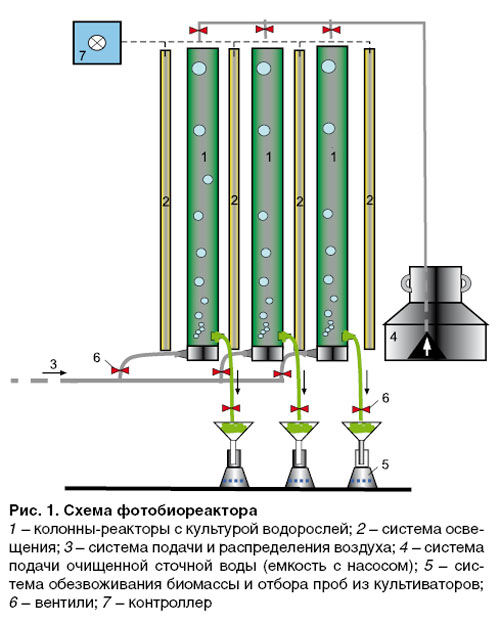
Подача воздуха осуществляется круглосуточно, освещение колонн – 12 часов в сутки, освещение регулируется контроллером. Температура воды в реакторах 22–25°С. Колонны являются периодическими реакторами с заменой части жидкости один раз в сутки. Сливаемая суспензия фильтруется через фильтр «белая лента» с использованием вакуумного насоса. Отфильтрованная биомасса взвешивается. В колоннах заданы три разных режима, отличающиеся значением водообмена (объем водорослевой суспензии, заменяемой ежесуточно в реакторе сточной водой, выраженный в процентах от общего объема колонны).
Для исследований были выбраны три реактора со следующими режимами: в первый реактор осуществлялась подача биологически очищенной воды, возраст культуры – трое суток (треть объема реактора один раз в сутки заменяется биологически очищенной водой); во второй и третий реактор подается осветленная вода, возраст культуры во втором реакторе – трое суток, в третьем – двое суток (водообмен – половина объема реактора в сутки).
Пробы биомассы на анализ концентрации пигментов и флуоресценцию отбирались в нестерильные пластиковые бутылки объемом 1 л. Флуоресцентный анализ проб начинался не позднее двух часов после их отбора.
Измерение параметров флуоресценции хлорофилла в суспензии водорослей проводилось на сертифицированном импульсном флуориметре, созданном на кафедре биофизики биологического факультета МГУ им. М. В. Ломоносова, для измерения сильно разбавленных суспензий микроводорослей [13]. В адаптированных к темноте образцах регистрировалась постоянная F0 и максимальная флуоресценция Fm, а также относительный выход переменной флуоресценции (Fm – F0)/Fm = Fv/Fm, который является мерой квантовой эффективности фотосистемы 2.
Эффективность первичных процессов фотосинтеза Fv/Fm представляет собой безразмерную энергетическую характеристику, аналогичную коэффициенту полезного действия и не зависящую от видовой специфики организма [8]. Уровень постоянной флуоресценции F0с высоким коэффициентом корреляции соответствует суммарному содержанию пигментов фотосинтетического аппарата фитопланктона, осуществляющих светосбор энергии и соответственно также коррелирует с обилием клеток водорослей [12]. Поэтому он может быть использован для оценки ростовых процессов культур клеток. Использование флуориметрического метода для определения хлорофилла в составе фитопланктонных водорослей не предполагает какой-либо предварительной подготовки воды. Для измерений применяли также флуориметр WaterPAM («Walz», Германия).
Пробы воды на численность водорослей фиксировались раствором люголя (2 мл на 1 л воды). В дальнейшем численность измерялась микроскопированием с использованием счетной камеры Нажотта. Биомасса измерялась методом геометрического подобия, содержание хлорофилла «а» – экстракцией органическим растворителем пигмента с последующим спектрометрическим определением. Во всех пробах выявлялся видовой состав водорослей, а также численность и биомасса по основным группам (диатомовые, зеленые, сине-зеленые, золотистые, эвгленовые, прочие). Токсичность воды в реакторах определялась на приборе «Биотестер-2» с использованием в качестве биотеста инфузории Paramecium caudatum.
Измерения выполнялись в 2–3 повторностях. Обработка результатов производилась с использованием статистических методов по Фишеру.
Результаты
Оценка применения флуориметрического метода для технологического контроля фотобиореактора
Химический состав воды в реакторах. Осветленная вода отличается от очищенной б льшим содержанием биогенных элементов (соли аммонийные и нитратные, фосфаты) и растворенного органического вещества. Концентрация фосфатов (по фосфору), азота нитратов и азота аммонийного в реакторе с биологически очищенной водой в среднем составляла 1,66; 13,63; 2,5 г/л соответственно, в реакторе с осветленной водой – 5,65; 0,04 и 24,2 мг/л. Исходное содержание хлорофилла «а» – 0,001–0,002 мг/л.
Видовой состав водорослей фотобиореактора. Вопрос формирования видового состава водорослей в реакторе с начала исследований был основным. Наиболее продуктивными, как известно, являются реакторы с одним видом водорослей. Однако поддержание стерильности в реакторе, доочищающем хозяйственно-бытовые стоки, нереально. С очищенными водами постоянно поступают водоросли, растущие во всех сооружениях очистки, – от открытых каналов поступающей воды до вторичных отстойников.
В самом начале эксперимента в фотобиореактор была добавлена культура водорослей Scenedesmus. Регулярное обследование видового состава водорослей в поступающей и доочищенной воде показало, что разнообразие видов исходной воды значительно выше, чем в реакторе. Если в поступающей воде за все время наблюдений зафиксировано 89 видов, то в воде реакторов – 22. Преобладают в обоих случаях зеленые и диатомовые водоросли. Видовой состав фотобиореактора был достаточно стабилен в течение всего времени наблюдения. Доминирующими видами в воде, поступающей в реакторы, являются: из диатомовых Nitzschia palea (Kutz.)W.Sm.,Stephanodiscus sp; из зеленых Scenedesmus quadricauda Chod., Scenedesmus opoliensis P.Richt.; из сине-зеленых (цианобактерий) Oscillatoria amphibia f. tenuis (Anissim.) Elenk.,Oscillatoria tenuis Ag.ex Gom,Chroococcus minutus. Доминирующими видами в воде реакторов являются из диатомовых: Dicthyosphaerium ehrenbergianum Nag., Navicula viridula Kutz,из зеленых: Scenedesmus obliquus (Turp.) Kutz., Scenedesmus parvus, из сине-зеленых: Oscillatoria amphibia f. tenuis (Anissim.) Elenk., из пирофитовых: Didymocystis lineata Korsch.,из эвгленовых: Astasia sp.
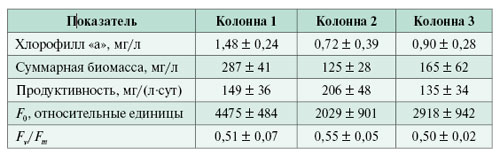
Как видно из анализа видового состава водорослей, в фотобиореакторе идет перестройка структуры сообщества. Большая часть биомассы формируется за счет видов Oscillatoria., Scenedesmus иAstasia. Суммарное количество биомассы этих видов в сливной воде может достигать 500–1000 г/м3. Данные по концентрации хлорофилла, содержанию биомассы, параметрам флуоресценции F0 и фотосинтетической активности Fv/Fm в фотобиореакторах приведены в таблице.
Технологические показатели продуктивности и характеристики флуоресценции. Основным технологическим параметром фотобиореактора является прирост биомассы на единицу объема реактора в единицу времени. Продуктивность зависит от нескольких факторов: содержания биогенных элементов, возраста культуры и токсичности подаваемой воды. Очищенная вода (первая колонна) характеризовалась возрастом культуры трое суток, меньшим содержанием биогенных элементов и отсутствием токсичности. Последнее подтверждено опытами с помощью биотестирования, индекс токсичности на инфузориях составил 0,26. Осветленная вода содержит бльшее количество биогенных элементов, причем в основном в виде аммонийных солей, которые потребляются водорослями в первую очередь. Однако осветленная вода имеет уровень токсичности выше, чем биологически очищенная. Индекс токсичности по биотестированию на инфузориях изменялся от 0,35 до 0,89. Максимальные значения (0,72–0,89) – в третьей колонне. Первая и вторая колонны отличались по качеству подаваемой воды и не различались по возрасту культуры (трое суток). Во вторую и третью колонны подавалась осветленная вода при возрасте культуры трое и двое суток соответственно. Средние значения продуктивности в колоннах реактора различались: 149, 206, 135 мг/(л·сут) по сырой биомассе при разбросе значений не более 25% от абсолютных величин (таблица).
Плотность водорослевой культуры, которая определялась в сливной жидкости ежедневно, также различалась. Содержание сырой биомассы водорослей в трех колоннах реактора составляло 287, 125 и 165 мг/л соответственно.
Параметры флуоресценции F0 и Fv/Fm определялись в пробах из реакторов, различающихся скоростью роста культуры и степенью угнетенности токсическими веществами. Коэффициент корреляции между средними значениями F0 для трех колонн реактора и концентрацией хлорофилла «а» составляет 0,98, между F0 и содержанием биомассы – 0,99 (рис. 2).
Активность реакционных центров фотосистемы 2, связанную с выделением кислорода при фотосинтезе, можно оценивать по параметру флуоресценции Fv/Fm. Этот параметр, отражающий максимальный квантовый выход фотосистемы 2, позволяет судить о фотосинтетической активности культуры микроводорослей фотобиореактора. В природных водоемах, богатых элементами минерального питания, значения параметра Fv/Fm могут достигать 0,6–0,7. При действии стрессовых факторов и загрязняющих веществ этот показатель может уменьшаться. У мертвых клеток он равен нулю.
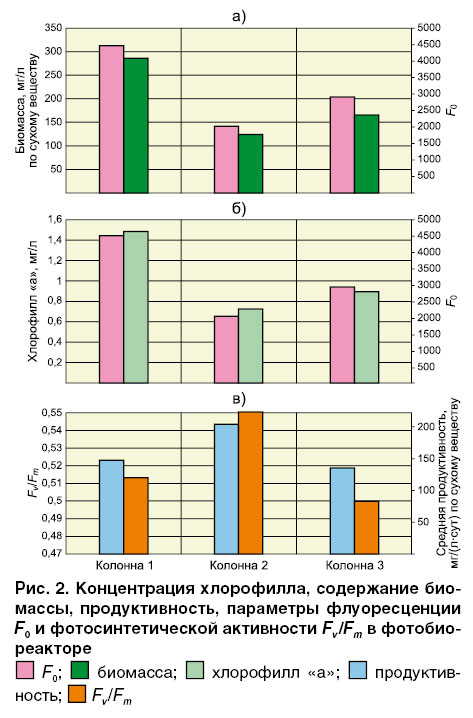
Значения параметра Fv/Fm для трех колонн реактора составляли 0,46–0,58. Выявлена тенденция прямой корреляционной зависимости показателя Fv/Fm от продуктивности фотобиореактора (таблица, рис. 2).
На основании полученных результатов можно утверждать, что для технологических процессов флуориметрический метод позволяет определить не только количество биомассы водорослей (по показателю F0), находящихся в фотобиореакторе, но и продуктивность реактора. При увеличении количества биомассы возрастает значение параметра Fv/Fm, что может свидетельствовать о возрастании токсичности воды, либо о недостатке биогенных элементов, либо о другом изменении технологического режима, который снижает эффективность работы фотобиореактора. Непрерывный контроль с помощью приборов двух названных показателей позволит своевременно принять технологические меры по стабилизации биомассы фотобиореакторов.
Выводы
Интенсивность фотосинтеза планктонных водорослей в условиях культивирования может служить универсальным показателем качества водной среды благодаря высокой чувствительности фотосинтеза к загрязняющим веществам разного генезиса. Данные, полученные в результате проведенных исследований, продемонстрировали, что флуоресцентный метод оценки фотосинтеза применим для проведения технологического мониторинга при выращивании биомассы микроводорослей. Метод позволяет значительно сократить трудозатраты при проведении контроля процесса и автоматизировать мониторинг.
Список цитируемой литературы
- Benemann J. R. Biofixation of CO2 and greenhouse gas abatement with microalgae – technology roadmap: Report № 7010000926 prepared for the U.S. Department of Energy National energy technology laboratory, 2003.
- Щеголькова Н. М., Мойжес О. В., Шашкина П. С. Фотобиореактор для очистки сточной воды от биогенных элементов и обеззараживания // Вода: химия и экология. 2010. № 2.
- Chen P., Zhou Q., Paing J., et al. Nutrient removal by the integrated use of high rate algal ponds and macrophyte systems in China // Water Science & Technology. 2003. 48 (2).
- Eisenberg D. M., Koopman B. L., Benemann J. R., Oswald W. J. Algal bioflocculation and energy conservation in microalgae sewage ponds // Bioengineering and Biotechnology. 1981. № 11.
- Weissman J. C., Goebel R. P., Benemann J. R. Photobioreactor design: comparison of open ponds and tubular reactors // Bioengineering and Biotechnology. 1988. № 31.
- ГОСТ 17.1.4.02-90. Вода. Методика спектрофотометрического определения хлорофилла «а».
- Falkowski P. G., Raven J. Aquatic Photosynthesis. – Oxford, Blackwell, 1997.
- Маторин Д. Н., Осипов В. А., Яковлева О. В., Погосян С. И. Определение состояния растений и водорослей по флуоресценции хлорофилла: Учебно-методическое пособие. – М.: МГУ. Макс пресс, 2010.
- Mаторин Д. Н., Венедиктов П. С. Люминесценция хлорофилла в культурах микроводорослей и природных популяциях фитопланктона / Итоги науки и техники. Cер. Биофизика. – М., ВИНИТИ, 1990. Вып. 40.
- Маторин Д. Н. Использование флуоресцентных методов измерения активности фотосистемы II при биомониторинге фитопланктона // Биофизика. 2000. Т. 45. № 3.
- Рубин А. Б. Биофизика фотосинтеза и методы экологического мониторинга // Технология живых систем. 2005. Т. 2.
- Matorin D. N., Antal T. K., Ostrowska M., et al. Chlorophyll fluorometry as a method for studying light absorption by photosynthetic pigments in marine algae // Oceanologia. 2004. V. 46. № 4.
- Пат. 2354958, РФ. МПК G 01 N 21/64. Способ флуорометрического определения параметров фотосинтеза фототрофных организмов, устройство для его осуществления и измерительная камера / С. И. Погосян, Ю. В. Казимирко, Д. Н. Маторин и др. / Изобретения. Полезные модели. 2009. № 13.






