№6|2010
ENVIRONMENTAL PROTECTION
bbk 000000
UDC 628.162.82:661.491.001.2
Deferrization of Natural Water Using Ozonization in Presence of Hydrogen Peroxide
Summary
Results of studies and laboratory tests of the water deferrization technology using jointly ozone and hydrogen peroxide at the laboratory unit are presented; high efficiency of the technology considered is shown.
Key words:
ozonization , hydrogen peroxide , oxidation , catalytic action
Очистка природных вод от соединений железа является в ряде случаев довольно сложной задачей, которая оптимально может быть решена только при использовании комплексной технологии. Это обстоятельство в первую очередь связано с многообразием соединений железа, присутствующих в природных водах.
Наиболее широко применяемые способы обезжелезивания воды (аэрация, известкование, катионирование) малоэффективны при высоких концентрациях железа (≥ 10 мг/л) и при его содержании в форме коллоидных частиц (сульфидов и комплексных соединений с гуматами и фульвокислотами). Поскольку железо в природных водах присутствует преимущественно в двухвалентной форме, технология обезжелезивания, как правило, включает следующие стадии: окисление соединений Fe (II) в Fe (III); гидролиз катионов Fe3+; отделение образующейся взвешенной фазы гидроксида трехвалентного железа отстаиванием и (или) фильтрацией.
Для окисления комплексных соединений железа необходимы более сильные окислители, чем кислород воздуха, наиболее эффективным из которых является озон. Однако прямое обезжелезивание воды методом озонирования при существенном сокращении времени обработки требует значительного расхода озона – от 1 мг/мг железа [1] до ≥ 2 мг/мг железа [2; 3], что приводит к высоким энергозатратам и соответственно к высокой стоимости очистки. Поэтому большой интерес представляют методы повышения эффективности озонолиза, в частности, совместное применение озона (О3) и пероксида водорода (H2O2).
Окисление двухвалентного железа пероксидом водорода исследовалось в работе [4]. При исходной концентрации двухвалентного железа ~ 6 мг/л для достижения остаточной его концентрации 0,2 мг/л необходима трехкратная доза окислителя (при удельной дозе Н2О2 ~ 1 мг/мг железа) [4]. Совместное применение озона и пероксида водорода рассматривалось для дезодорации воды: при дозах озона 7 мг/л и пероксида водорода 3 мг/л запах воды снижался с 4 до 1–2 баллов [5]. Однако для обезжелезивания воды данная технология не исследовалась.
Для повышения эффективности обезжелезивания воды с высоким содержанием двухвалентного железа (≥ 20 мг/л) были проведены экспериментальные исследования по совместному применению озона и пероксида водорода. При этом особое внимание уделялось определению оптимальной концентрации дозируемого пероксида водородаи возможности сокращения времени озонолиза.
Экспериментальные исследования проводились в лабораторных условиях на модельных растворах, приготовленных на дистиллированной воде, с исходным содержанием катионов Fe2+ 20–30 мг/л. Процесс окисления Fe (II) в Fe (III) заключался в следующем: в барботажную камеру (диаметр 5 см, объем 500 мл) заливался раствор соли Fe (II), добавлялся до необходимой концентрации пероксид водорода и при фиксированной скорости газового потока ( = 14,2 л/ч) подавался диспергированный озонированный воздух (концентрация озона 1 мг/л). Через определенные интервалы времени проводился отбор проб и анализ остаточной концентрации Fe (II).
Так как кинетика окисления Fe2+ в Fe3+ удовлетворительно описывается формальным уравнением кинетики первого порядка (рис. 1), в качестве критерия сенсибилизирующего действия пероксида водорода было выбрано сопоставление эффективных констант скорости реакций окисления в присутствии Н2О2 по отношению к прямому озонированию. Рассчитанные по результатам экспериментов эффективные константы скорости в зависимости от концентрации добавленного пероксида водородаприведены в табл. 1. Из данных таблицы следует, что оптимальная концентрация Н2О2 для исследованного содержания Fe (II) составляет 2–3 мг/л, при этом скорость окисления Fe (II) в присутствии Н2О2 возрастает в 15–20 раз.
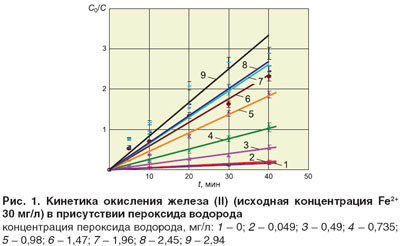
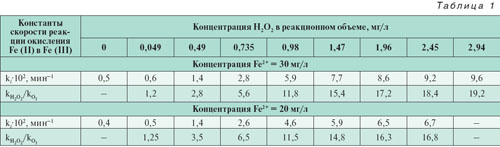
Анализ экспериментальных данных показывает, что на протяжении всего времени озонолиза в присутствии Н2О2 механизм реакции окисления Fe (II) оставался неизменным, о чем свидетельствует линейность полученных зависимостей (рис. 1). Кроме того, введение в реакционный объем пероксида водорода, например с концентрацией 1 мг/л, увеличивает скорость окисления более чем на порядок (табл. 1), в то время как по уравнению реакции:
2Fe2+ + Н2О2 + 2H+ ↔ 2Fe3+ + 2Н2О (1)
эффективность окисления должна возрасти не более чем на 20%. Совокупность данных фактов позволяет предположить о каталитическом действии пероксида водорода на озонолиз растворов Fe (II).
Для подтверждения каталитического действия Н2О2 исследовалась кинетика окисления только пероксидом водорода, прямым озонированием и совместным действием Н2О2 и О3 (концентрация озона в озонированном воздухе во всех экспериментах составляла 0,162 мг/л, пероксида водорода – 0,62 мг/л, Fe2+ – 20 мг/л). Экспериментальные результаты в координатах уравнения кинетики первого порядка приведены на рис. 2. Рассчитанные эффективные константы скорости реакции окисления соответственно составили: для окисления пероксидом водорода (0,57 ± 0,07)·10–2 мин–1; для прямого озонолиза (1,92 ± 0,23)·10–2 мин–1; для совместного действия Н2О2 и О3 (4,8 ± 0,6)·10–2 мин–1.
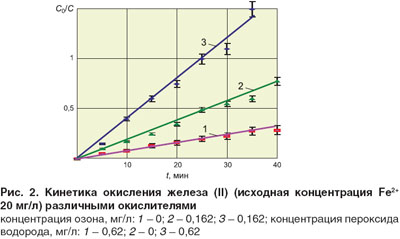
Из сопоставления полученных констант следует, что введение пероксида водорода при озонировании сопровождается синергетическим эффектом: константа скорости совместного процесса превышает сумму констант скорости прямого озонолиза и окисления пероксидом водорода: 4,8·10–2 > (1,92 + 0,57)·10–2.
Каталитическое действие пероксида водорода может быть объяснено протеканием следующих реакций.
На первой стадии взаимодействие озона с пероксидом водорода приводит к образованию высокореакционных радикалов:
Н2О2 + О3 НО.2 + ОН. + О2. (2)
Образовавшиеся радикалы окисляют катионы Fe2+:
Fe2+ + ОН. Fe3+ + ОН–; (3)
Fe2+ + НО.2 Fe3+ + НО2–. (4)
Гидролиз пероксид-аниона НО2– вновь приводит к образованию Н2О2:
НО2– + Н2О Н2О2 + ОН–. (5)
При озонировании введение в реакционный объем пероксида водорода увеличивает скорость окисления Fe (II) более чем на порядок (табл. 1). Однако для достижения санитарно-гигиенических норм по содержанию железа в питьевой воде (0,3 мг/л), как следует из рассчитанных эффективных констант скорости окисления (табл. 1), требуется значительное время озонирования. Для сокращения времени озонирования в работе [6] предложено проводить окисление до остаточных концентраций железа 1–1,2 мг/л с последующей фильтрацией через песчаный фильтр. При этом достигается практически полное обезжелезивание воды при удельной дозе озона 0,11–0,17 мг/мг железа. Применение данного метода ограничено низкой грязеемкостью песчаных фильтров, поскольку требуется частая регенерация, и продолжительностью выхода фильтров на стационарный режим работы, которая составляет до 12,5% времени фильтроцикла, что в целом усложняет и удорожает процесс обезжелезивания
воды.
В связи с этим исследовалась возможность применения в качестве фильтрующей загрузки гранулированного мрамора, активированного гидроксидом железа (III), после предварительного озонирования в присутствии пероксида водорода. Известно, что каталитическим действием на окисление железа (II) обладает Fe(OH)3, который тонким слоем наносится на зернистую загрузку, используемую на заключительном этапе фильтрации воды [7]. Активацию мраморной крошки (фракция 1–3 мм), обладающей бльшим объемом межпорового пространства, чем песчаные фильтры, проводили кипячением в течение 5 минут в растворе FeCl3. При достижении содержания железа в воде на выходе из фильтра выше санитарных норм фильтр подвергали регенерации противоточной водовоздушной промывкой.
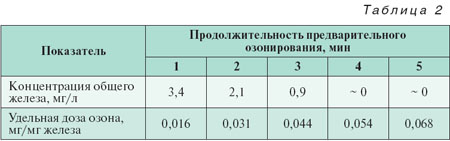
Эксперименты по инициированию процесса окисления Fe (II) при совместном действии озона и пероксида водорода с последующим доокислением и отделением взвешенной фазы Fe(OH)3 проводили на модельных растворах с концентрацией Fe2+ 24 мг/л. В барботажную камеру заливали 500 мл модельного раствора, добавляли Н2О2 в концентрации 2,5 мг/л и подавали в течение определенного времени диспергированный озонированный воздух (υвозд = 60 л/ч, концентрация озона 0,162 мг/л). После завершения озонирования вода подавалась в контактный фильтр, заполненный гранулированным мрамором, активированным Fe(ОН)3 (объем загрузки 180 см3, высота слоя 36 см, скорость фильтрования 0,6 м/ч). В фильтре завершался процесс окисления двухвалентного железа и происходило отделение образовавшейся взвешенной фазы Fe(ОН)3. В воде на выходе из фильтра измерялась концентрация общего железа. Зависимость концентрации железа в фильтрате от времени предварительного озонирования приведена в табл. 2, из которой следует, что для практически полного обезжелезивания воды при данной исходной концентрации Fe (II) удельная доза озона составляет 0,05–0,06 мг/мг железа, а это существенно меньше дозы, используемой в традиционной технологии [1–3].
Выводы
1. Результаты экспериментальных исследований показали, что введение пероксида водорода при обезжелезивании природной воды с высоким содержанием железа методом озонирования приводит к синергетическому эффекту: скорость окисления Fe (II) при совместном действии реагентов значительно превышает суммарную скорость прямого озонирования и окисления пероксидом водорода.
2. Применение в качестве фильтрующей загрузки гранулированного мрамора, активированного гидроксидом железа (III), позволяет ограничиться лишь кратковременной обработкой воды озоном совместно с пероксидом водорода для инициирования процесса окисления, поскольку полное окисление с одновременным отделением образовавшейся взвешенной фазы Fe(OH)3 протекает в объеме фильтрующей загрузки.
SPISOK LITERATURY
- Kozhinov V. F. Ustanovki dlja ozonirovanija vody. – M.: Strojizdat, 1968.
- Solncev V. V., Shafit Ja. M., Romashkin A. V. i dr. Primenenie ozonatornogo oborudovanija firmy «Ozonija» pri ochistke prirodnyh vod Krajnego Severa // Vodosnabzhenie i san. tehnika. 2007. № 4.
- Alekseeva L. P., Draginskij V. L. Ochistka podzemnyh vod gorodov Tjumenskogo regiona // Vodosnabzhenie i san. tehnika. 2004. № 10.
- Semokov A. V., Chekmarev S. V., Maslij V. D., Skuratov Ju. I. Obezzhelezivanie podzemnyh vod s ispol'zovaniem perekisi vodoroda // Vodosnabzhenie i san. tehnika. 2007. № 2.
- Kalashnikova E. G., Arutjunova I. Ju., Smirnov A. D. Issledovanie razlichnyh metodov dezodoracii vody pri vodopodgotovke // Vodosnabzhenie i san. tehnika. 2007. № 1.
- Draginskij V. L., Alekseeva L. P., Samojlovich V. G. Ozonirovanie v processe ochistki vody. – M: DeLi print, 2007.
- Kul'skij L. A., Strokach P. P. Tehnologija ochistki prirodnyh vod. – Kiev: Vysshaja shkola, 1986.






